Сравнение пространственного расположения функциональных групп нуклеиновых оснований на поверхности большой канавки двухспиральной ДНК и функциональных групп коротких пептидов показывает, что эти полиамфолитные структуры имеют возможность многоточечного комплементарного взаимодействия. В качестве примера представлена модель комплементарного связывания синтетического тетрапептида эпифиза Ala-Glu-Asp-Gly с последовательностью нуклеотидов АТТТС в составе ведущей цепи двойной спирали ДНК, которая многократно повторяется на промоутерных участках генов теломераэы и РНК полимераэы II. Показано, что регуляторные пептиды и комплементарные им блоки в составе двухспиральной ДНК могут быть связаны протон-донорными и протон-акцепторными взаимодействиями с участием молекул гидратационной воды.
Как известно, нормальная клетка отвечает на внешние или внутренние изменения изменением интенсивности транскрипции активных генов и синтеза РНК, Одним из факторов патологического состояния организма является замедление этих процессов, в частности, нарушение процессов инициирования транскрипции [12]. В то же время появились сообщения о том, что некоторые белки, контролирующие клеточный цикл, могут быть активны как факторы транскрипции [16].
Вопрос о механизме инициирования транскрипции решается исследованием структур факторов транскрипции и определением их сайтов связывания с двойной спиралью ДНК на промоутерном (некодирующем) участке гена. Со времени появления первых работ в этой области в начале 80-х годов были найдены общие структурные мотивы в строении факторов транскрипции некоторых генов и их комплексов с определенными последовательностями нуклеотидных пар двойной спирали ДНК на промоутерных участках генов [34, 35]. Установлено, что в ядросодержащих клетках активация хроматина и контроль транскрипции осуществляются сложной системой агонистов и факторов транскрипции, включающей как высокомолекулярные белки, так и низкомолекулярные пептиды и короткие пептиды [22, 37].
Тогда казалось, что специфическая активность многих высокомолекулярных факторов транскрипции локализована на сравнительно коротких участках пептидной цепи, состоящих из 30—100 аминокислотных остатков [31]. Эти наблюдения выделили новую проблему фармакологии и медицины. Требовалось определить, какова минимальная длина и аминокислотная последовательность короткого пептида, непосредственно и селективно контактирующего с промоутерным участком гена и способного имитировать действие фактора транскрипции. Более подробно молекулярные механизмы инициирования транскрипции в клетках представлены в монографии [27. Р. 341—403].
Обычный подход к отысканию сайта связывания в структуре белка состоит в использовании иммуноспецифических методов. Так, например, был определен участок В-цепи ламинина, состоящий из 14 аминокислотных остатков, ответственный за адгезию эпителиальных клеток. Дальнейшие исследования показали, что этот пептид может быть укорочен до пяти аминокислотных остатков с полным сохранением селективности связывания с рецептором [19]. Аналогичная задача была поставлена и практически решалась для пептидного гормона эритропоэтина. Гормон эритропоэтин (ММ 46000) способствует пролиферации, дифференцировке и выживанию клеток-предшественников эритроцитов. В библиотеке пептидов методом селекции были найдены короткие пептиды (14 аминокислотных остатков), проявляющие активность, аналогичную нативному гормону [41].
В то же время были выделены и исследованы эндогенные регуляторные пептиды человека, которые проявляли тканеспецифическую активность при использовании в сверхмалых концентрациях. Исследование продуктов гидролиза гемоглобина и пептидов, содержащихся в питательной среде при культивировании человеческих эритроцитов, показало, что короткие отрезки цепей глобинов проявляют активность, несвойственную исходному гемоглобину: они связываются с опиатными рецепторами, потенцируют действие брадикинина [24]. Регуляторные пептиды были также выделены из живой культуры клеток костного мозга, исследованы в отношении специфической регуляторной активности и названы миелопептидами [6].
Эксперименты последних лет показали, что как природные пептидные препараты, так и их синтетические аналоги - тетрапептиды определенной структуры — проявляют тканеспецифическую активность, участвуя в активации хроматина и нормализуя ритм белкового синтеза в культуре тканей [1, 4, 5, 9] и на уровне целого организма [10, 13, 26, 32]. Можно предполагать, что короткие пептиды, поддерживающие аутокринную регуляцию, являются миметикамн и агонистами высокомолекулярных факторов транскрипции.
Механизмы проникновения коротких пептидов в клетку и в клеточное ядро могут быть различны. По мнению И.П. Ашмарина, механизм проникновения нейропептидов в клетку и в геном нейрона аналогичен механизму проникновения стероидных гормонов. Более гидрофильные короткие пептиды в отличие от стероидных гормонов для преодоления липидных мембран связываются с гидрофильными группами фосфолипидов на внешней стороне мембран, группируются и входят в клетку, используя механизм, близкий к пиноцитозу [2]. Образование комплексов «белок-белок» и их диссоциация — общий механизм внутриклеточных транспортных процессов. В цитоплазме находятся стероидные рецепторы, содержащие в структуре домен «С4 цинковый палец». В отсутствие стероидного гормона этот рецептор связан с белком hsp 90 (heat stock protein), который всегда присутствует в цитоплазме. При появлении стероидного гормона этот неактивный комплекс диссоциирует, и стероидный гормон связывается с рецептором, образуя активный комплекс, который направляется в ядро, где связывается с регуляторным участком целевого гена и активирует (или репрессирует) его транскрипцию [31].
Современные представления о проницаемости цитоплазматической и ядерной мембран показывают, что для проникновения через эти мембраны существуют и диффузионные пути.
Кроме известных ранее ионных каналов и процессов пиноцитоза, были открыты каналы, образованные семейством трансмембранных белков поринов, присутствующих в митохондриальной и цитоплазматической мембранах [25]. Эти белки имеют в своем составе до 50% гидрофильных аминокислот и структурные мотивы амфифильной а-спирали. Однако большая часть пептидной цепи находится в р-конформации. Несколько трансмембранных цепей поринов образуют бочкообразные (barrel-shaped) поры, которые проницаемы для малых гидрофильных и амфифильиых молекул (мочевина, глицерин, триптофан и др.). Например, при разнице концентраций триптофана 0.001 М его диффузионный поток через мембрану составит 600 молекул в секунду через 1 мкм2 поверхности мембраны [12. Р. 509].
Семейство поринов включает подсемейство аквапоринов — белков, контролирующих потоки воды в клетку и из клетки в зависимости от небольших изменений рН внешней среды [17].
Мембраны ядра также имеют развитую систему транспортных пор, образованных белковыми комплексами— нуклеопоринами, которые контролируют транспорт нуклеопротеиновых комплексов в ядро и из ядра [33]. Внутренний диаметр нуклеопор имеет порядок 42 н.м, так что они проницаемы для диффундирующих молекул с молекулярной массой до 5000 Да [27. Р, 69].
Таким образом, возможность проникновения коротких пептидов в клетку и в клеточное ядро не вызывает принципиальных сомнений. Наши экспериментальные исследования согласуются с представлениями о проникновении коротких пептидов в клетку и ее ядро, так как после добавления пептида в культуру клеток выявлены изменения в состоянии хроматина, В работах [1, 8, 13] на клетках в культуре тканей было доказано, что короткие синтетические пептиды не только проникают в клетку через цитоплазматическую и ядерную мембраны, но и участвуют в активации отдельных генов, в частности гена теломеразы [5].
В работе [9] было исследовано воздействие коротких синтетических пептидов на изменения гетерохроматина в лейкоцитах и обнаружена активация рибосомных генов, деконденсация плотно упакованных фибрилл хроматина и высвобождение генов, репрессированных в результате возрастной конденсации эухроматиновых районов клеток.
Однако до настоящего времени существует очевидный разрыв между многочисленными наблюдениями регуляторных воздействий нейрогормонов и синтетических олигопептидов на состояние хроматина и представлениями о молекулярных механизмах селективного связывания этих пептидов с промоутерными участками генов.
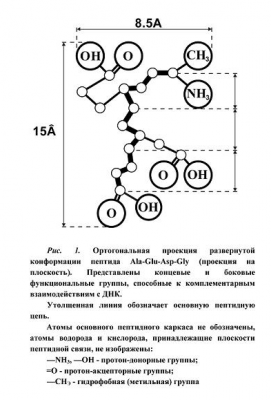
Среди коротких синтетических пептидов, исследованных нами ранее в отношении активации хроматина, наибольшую эффективность проявил синтетический тетрапептид эпифиза (Ala-Glu-Asp-Gly) [1, 4, 8, 9]. Этот пептид представляет также особый интерес, так как он проявляет высокую геропротекторную активность. Мы исследовали особенности строения этого пептида для отыскания параметров соответствия между специфической для этого пептида аминокислотной последовательностью и последовательностью нуклеотидов в структуре двойной спирали ДНК. Предлагается модель специфического связывания пептида с сайтом узнавания на промоутерном участке гена, построенная по принципу геометрической и электрохимической комплементарнсти двух правоспиральных молекул — пептида и двойной спирали ДНК.
Основы комплементарных взаимодействий в системе «Олигопептид — олигонуклеотид»
Цель нашей работы состояла в отыскании возможного механизма селективного узнавания и связывания коротких пептидов с той частью генетического аппарата, которая ответственна за инициирование белкового синтеза.
Механизм узнавания в системе «пептид — ДНК» по принципу «одна аминокислота — одна пара нуклеотидов» не может быть специфическим [14]. Из 20 аминокислот по крайней мере 8 могут связываться одновременно с функциональными группами двух соседних пар оснований, так как имеют достаточно длинные и подвижные боковые функциональные группы. Однако селективность такого связывания невелика. Аминокислоты с ароматическими боковыми группами могут связываться с двойной спиралью ДНК в результате взаимодействия ароматических колец аминокислот и нуклеотидов [5, 20].
Более высокая селективность (избирательность) узнавания и связывания обеспечивается кооперативным многоточечным взаимодействием в системе «олигопептид — олигонуклеотид».
Молекулярное узнавание в биологии основано на точном соответствии молекулярных поверхностей взаимодействующих молекул и совпадении метрических параметров расположения на этой поверхности взаимодействующих функциональных групп [39]. Структурное соответствие такого рода называется матричной комплементарностью.
Пептидная цепь, состоящая из L-изомеров, может иметь несколько конформаций. В частности, Р-структурные формы пептидной цепи имеют наиболее вытянутую форму и относятся к развернутому типу пептидных конформаций, при которых расстояние, приходящееся на один аминокислотный остаток, равняется 3.4 А [12. Р. 114]. Эта конформация обеспечивает достаточную свободу боковых групп и позволяет им осуществлять наибольшее число межмолекулярных взаимодействий [7]. Ориентация боковых групп аминокислотных остатков зависит от возможности межмолекулярных взаимодействий с другой макромолекулой или с компонентами окружающей среды.
При построении модели матричной комплементарности тетрапептида с соответствующим участком двойной спирали ДНК использованы литературные данные о геометрических характеристиках двойной спирали ДНК и пептидной цепи [5, 38, 7] и о закономерностях полифункционального взаимодействия ДНК с полиамфолитами [3, 18].